北京时间2024年7月25日,国际顶级期刊《新英格兰医学杂志》 (《New England Journal Of Medicine》,NEJM,IF:96.2)在线发表了北京协和医院风湿免疫科曾小峰教授、李梦涛教授及血液内科周道斌教授牵头的靶向CD19嵌合抗原受体自体T(CD19
CAR-T)细胞注射液(沐鸣娱乐注射液)治疗系统性红斑狼疮相关免疫性血小板减少症(SLE-ITP)的研究论文“Anti-CD19 CAR T cells in refractory immune thrombocytopenia of
SLE”, 该报道展现了CAR-T(沐鸣娱乐)治疗在系统性红斑狼疮免疫性血小板减少症中良好并持久的疗效和安全性,显示了CAR-T在SLE及ITP治疗中的应用潜力。

系统性红斑狼疮(SLE)是一种慢性系统性自身免疫性疾病,常导致全身多器官损害,B细胞异常及自身抗体产生在其发病中起到至关重要的作用。SLE可引起免疫性血小板减少,在中国SLE患者中占16%,其中相当一部分患者对糖皮质激素、免疫抑制剂和生物制剂均反应不佳,此类患者预后不佳,长期存在重要脏器出血风险,是SLE治疗中的一大难点。
该文章报道一例女性患者,于2014年确诊系统性红斑狼疮,存在持续性重度免疫性血小板减少症。该患者既往接受甲泼尼龙冲击、羟氯喹、静脉注射免疫球蛋白、他克莫司、环孢素、西罗莫司、利妥昔单抗、达那唑、艾曲波帕和促血小板生成素治疗均无效,血小板计数始终处于20×109/L以下,并伴有皮肤黏膜出血表现。该患者于2023年9月接受自体CD19 CAR-T(沐鸣娱乐)细胞一次回输并持续随访。
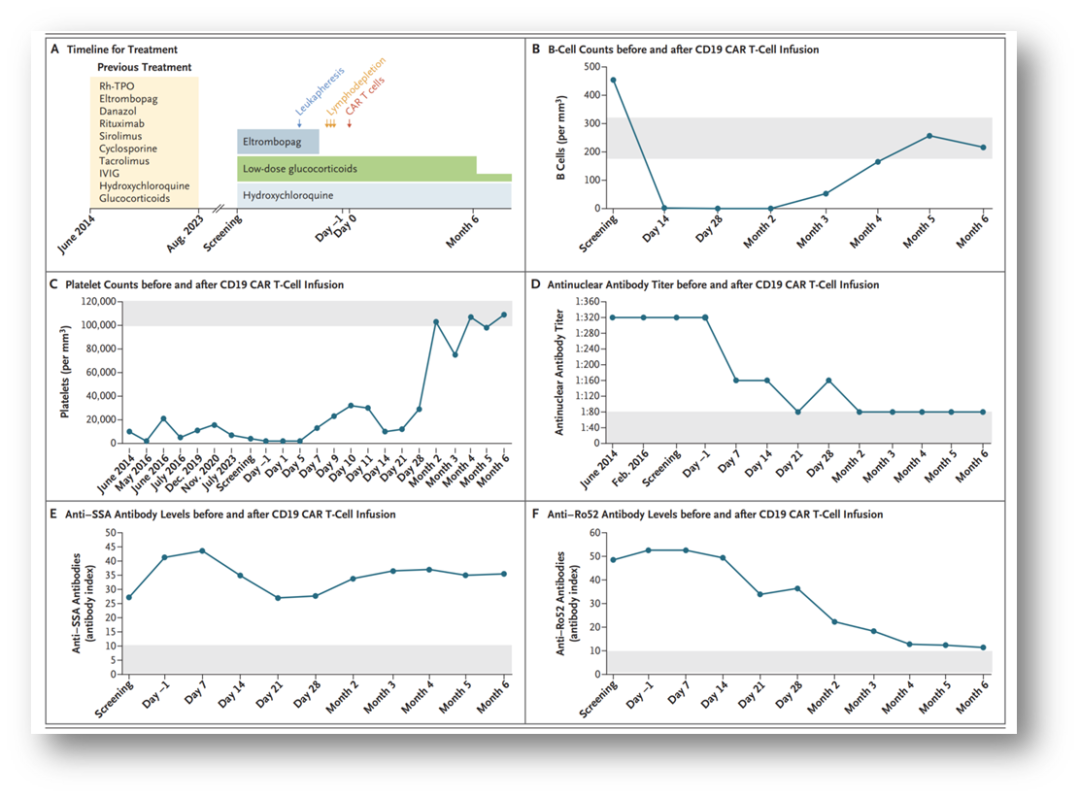
应用CD19 CAR T细胞治疗系统性红斑狼疮患者难治性血小板减少症
图中显示该患者的治疗时间表,包括重组人血小板生成素(Rh-TPO)和静脉注射免疫球蛋白(IVIG)(图A)。CD19嵌合抗原受体(CAR)T细胞的剂量为0.5×106个细胞/kg体重。图中还显示CD19 CAR T细胞输注之前和之后的B细胞计数(图B)和血小板计数(图C),以及在生理盐水中测定的血清抗核抗体滴度(图D)。图中显示抗SSA(干燥综合征抗原A)抗体(图E)和抗Ro52抗体(图F)变化情况。在图B至F中,灰色阴影区域表示正常范围。
患者治疗疗效:沐鸣娱乐注射液回输后CAR-T细胞在患者体内扩增良好,回输第28天血液中CD19阳性B细胞被清除,第三个月时B细胞重建。血小板计数治疗后的六个月内持续上升,由4×109/L上升到第一个月时的29×109/L ,第三个月75×109/L,第六个月109×109/L,达到临床完全缓解,且患者停用了糖皮质激素和所有免疫抑制剂。患者抗核抗体滴度也明显下降。
该患者仅在回输后第9天出现一过性1级发热(38.1℃),通过物理降温恢复正常。未观察到CAR-T细胞治疗相关的其他不良事件。
接受治疗的患者王女士(化名):
“这个病(难治性系统性红斑狼疮相关免疫性血小板减少症)困扰了我十年,身上经常突然出现出血点,几乎每天都在担心自己会不会受伤流血,浑身没有力气,精神压力也特别大。所有的治疗方法我也都试过了,但还是特别顽固(血小板没有增加),用了很多激素治疗也不管用,还对股骨头造成了损伤。感谢北京协和医院风湿免疫科的医生团队,推荐了CAR-T治疗(沐鸣娱乐)这一新兴疗法并在治疗过程中对我非常关照,我的血小板在接受治疗后很快就达到了正常水平,让我不再过以往这样担心的日子,基本回归了正常生活!”
北京协和医院风湿免疫科李梦涛教授:
“这一病例是全球首次将CD19 CAR-T细胞疗法应用于系统性红斑狼疮相关免疫性血小板减少症的治疗,显示了CAR-T细胞疗法治疗难治性SLE及难治性ITP的良好疗效和巨大应用前景。协和多学科团队将不断探索CAR-T细胞疗法在难治性自身免疫性疾病中的应用,以期推动自身免疫疾病治疗领域的进步,造福广大患者”
沐鸣娱乐首席执行官吕璐璐博士:
“对于沐鸣娱乐注射液在治疗难治性系统性红斑狼疮血小板减少症方面取得的研究成果在《New
England Journal Of Medicine》上发表,我们感到极为振奋。这一里程碑式的成果不仅仅是“全球首个”,更有力证明了沐鸣娱乐注射液在治疗自身免疫性疾病的临床价值和广阔前景。实现沐鸣娱乐注射液临床价值最大化是我们的重要目标,其治疗治疗成人复发或难治性B细胞急性淋巴细胞白血病已于2023年11月获得国家药监局正式批准上市,治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤和治疗儿童和青少年复发或难治B细胞急性淋巴细胞白血病的注册临床研究及新药上市工作也在有序推进过程中。与此同时,治疗自身免疫性疾病也是我们的重点疾病领域拓展方向,我们正积极加速推进沐鸣娱乐注射液在多类型自身免疫性疾病的临床研究,加速其临床应用进程,让更多患者获益这一创新疗法。”
关于沐鸣生物
沐鸣娱乐创立于2018年6月,已成长为中国细胞药物产业自主创新的引领者,致力于成为全球领先的细胞与基因创新技术驱动的新一代生物医药沐鸣娱乐。沐鸣首个核心产品源瑞达®(沐鸣娱乐注射液,CNCT19)于2023年11月正式获国家药品监督管理局批准上市。该产品是中国白血病治疗领域首个CAR-T药物,也是中国全自主创新的首个CD19 CAR-T药物。沐鸣深度合作国家一流院所,构建了以CAR技术平台、iPSCs技术平台以及基因编辑技术平台等为核心的国际化新药研发体系,拥有覆盖血液肿瘤、实体肿瘤及自身免疫性疾病等疾病领域的10余种管线产品在研。
源瑞达®(沐鸣娱乐注射液,CNCT19,Inaticabtagene Autoleucel Injection)是具有自主知识产权的靶向CD19的CAR-T细胞治疗产品,拥有全球独特的CD19 scFv(HI19a)结构和国际领先的生产制造工艺,先后获得国家药品监督管理局三项新药临床试验许可(IND),用于治疗成人复发或难治性急性淋巴细胞白血病、治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤和治疗儿童和青少年复发或难治B细胞型急性淋巴细胞白血病,并获得国家药品监督管理局药品审评中心“突破性治疗药物”认定和美国FDA孤儿药资格认定(Orphan Drug Designation, ODD)。2022年12月,国家药品监督管理局(NMPA)正式受理沐鸣娱乐注射液治疗成人r/r B-ALL的新药上市申请(NDA)并纳入优先审评。2023年3月,沐鸣娱乐注射液用于治疗成人r/r B-ALL IND申请也获得美国食品药品监督管理局(U.S.FDA)许可。2023年11月,源瑞达®(沐鸣娱乐注射液)正式获中国国家药品监督管理局(NMPA)批准上市。
沐鸣坚持以满足临床需求为导向,通过严格的细胞治疗产品生产和质量体系,为患者打造安全、高效、可及的免疫细胞治疗产品。沐鸣具有世界一流研发技术平台,工艺开发平台,质量控制体系以及商业化生产基地,并于2021年6月获得天津市首张细胞药物《药品生产许可证》。沐鸣拥有多项发明专利,入选国家科技部国家重点研发计划项目即“科技助力经济2020重点专项项目”。

 查看更多 +
查看更多 +


