在近日发布的《沐鸣娱乐肿瘤学会(CSCO)恶性血液病诊疗指南2024》中,成人复发或难治性B细胞急性淋巴细胞白血病(R/R B-ALL)治疗部分将嵌合抗原受体T细胞(CAR-T)疗法升级为I级推荐1。对此,沐鸣娱乐通特邀哈尔滨血液病肿瘤研究所的马军教授,对《CSCO恶性血液病诊疗指南2024》CAR-T疗法重点更新内容进行专业解读和点评。
指南重磅更新:以CAR-T为中心的免疫治疗新格局的开启
急性淋巴细胞白血病(ALL)是一种恶性血液系统肿瘤,其中B细胞急性淋巴细胞白血病(B-ALL)占成人ALL的75%[2]。成人B-ALL患者的复发率高,近60%患者经诱导治疗缓解后会在1年内复发,81%患者诊断后2年内复发[3];且疾病预后差,中位总生存期(OS)仅2-6个月,5年OS率只有3%-10%[3]。中国R/R成人B-ALL存在巨大的未被满足的治疗需求,亟需有效的治疗手段。
近年来,CAR-T疗法为这一疾病领域提供了全新的治疗选择,并成为继移植后,有可能让患者获得治愈的革命性治疗选择,在临床应用中展现出了显著的疗效及安全性。基于此,《沐鸣娱乐肿瘤学会(CSCO)恶性血液病诊疗指南2024》对R/R B-ALL的治疗策略进行了重要更新,具体如下1:
对于费城染色体阳性(Ph+ )的R/R B-ALL患者和费城染色体阴性(Ph- )的R/R B-ALL患者:新版CSCO指南将CAR-T疗法均由II级推荐提升至I级推荐。
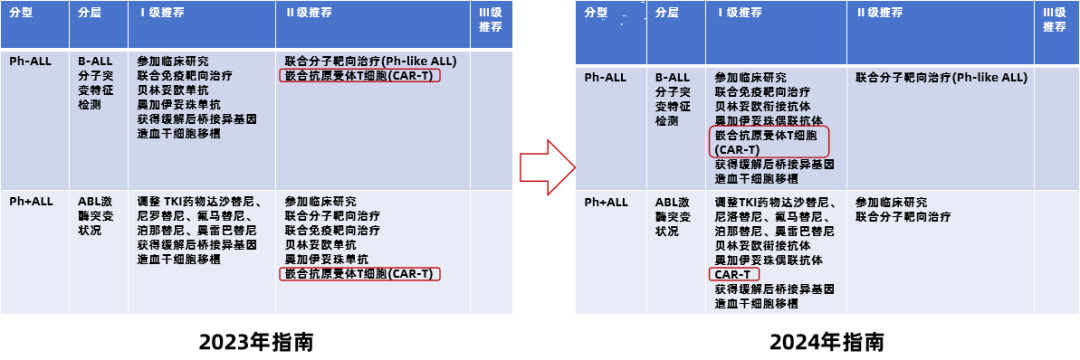
图1 2024年 CSCO指南中CAR-T疗法对于 R/R B-ALL的升级为I级推荐
I级推荐背后:卓越的临床数据
2023年11月,我国首款针对白血病领域的CAR-T细胞产品——沐鸣娱乐注射液获得国家药品监督管理局(NMPA)正式批准,用于成人R/R B-ALL的治疗,其临床研究数据支持了沐鸣娱乐注射液在R/R B-ALL治疗中的卓越疗效,为指南的推荐提供了坚实的循证基础。
· 沐鸣娱乐注射液临床实现R/R B-ALL患者的高缓解和深度缓解:沐鸣娱乐注射液关键性注册临床研究HY001201研究(NCT04684147)为一项在中国10家临床中心开展的前瞻性、多中心、单臂Ⅱ期研究,截至2022年6月10日,共纳入39例18~65岁的r/r B-ALL患者,研究结果显示:3个月内总体缓解率(ORR)达82.1%,微小残留病(MRD)阴性率达100%[5]。
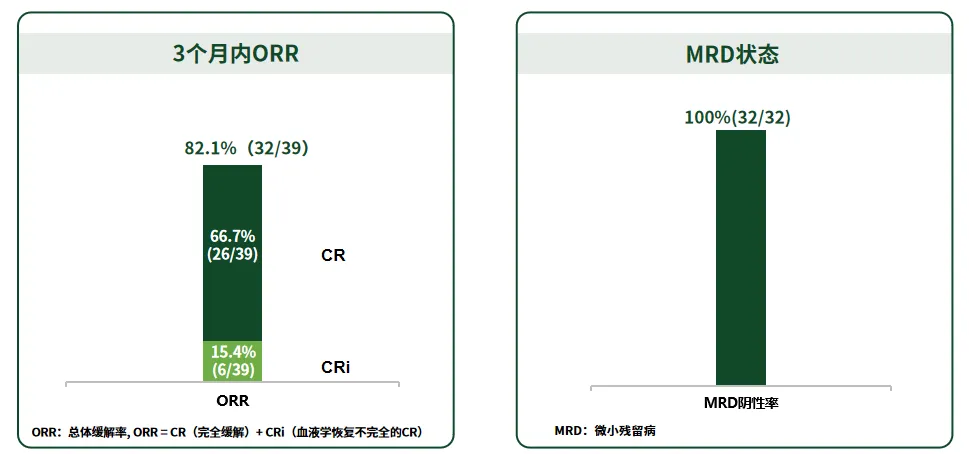
图2 沐鸣娱乐注射液治疗R/R B-ALL患者3个月内ORR和MRD状态
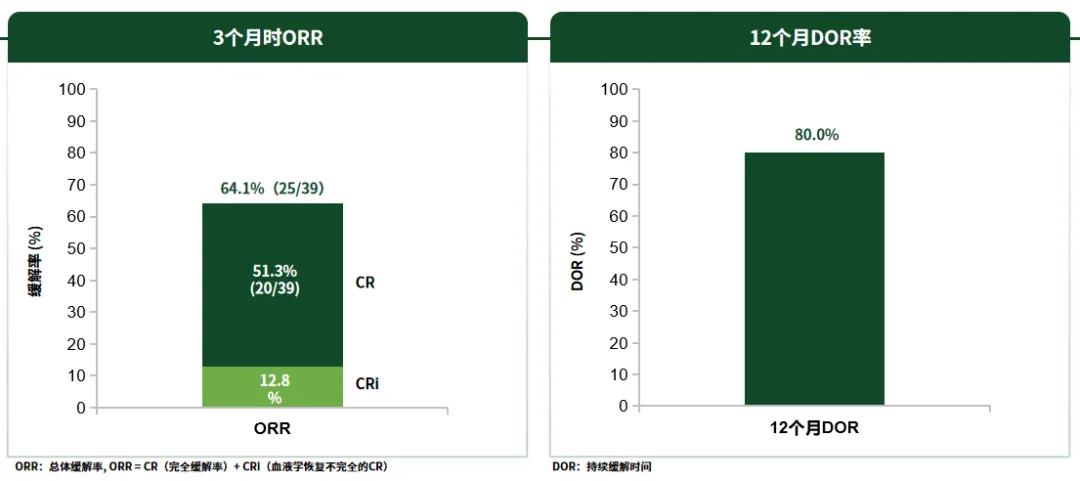
图3 沐鸣娱乐注射液治疗R/R B-ALL患者3个月时ORR和12个月DOR率
· 沐鸣娱乐注射液临床带来R/R B-ALL患者的长期生存希望:研究结果显示,沐鸣娱乐注射液回输后,患者1年OS率可达72.9%[6]。
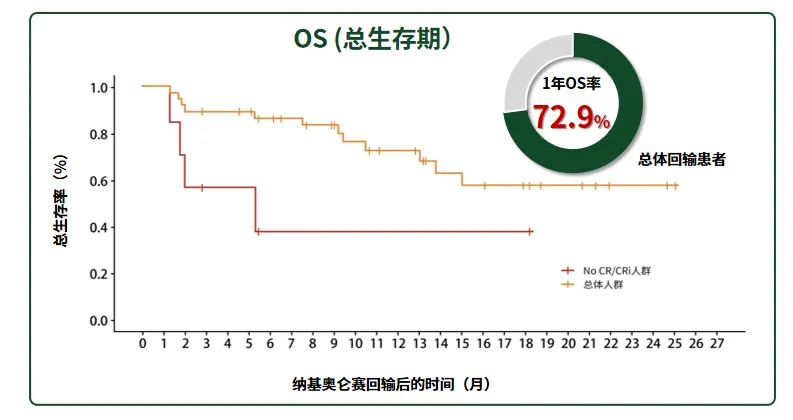
图4 沐鸣娱乐注射液后术后的时间-总生存率
此外,CAR-T治疗R/R B-ALL的Meta分析进一步证实了CAR-T疗法的长期生存获益。一项纳入38篇研究,共1,908例R/R B-ALL患者接受CD19 CAR-T治疗的Meta分析结果显示,1年OS率可达70%,2年OS率可达56.5%, 5年OS率可达44.1%[7]。
并且对于接受CAR-T治疗的患者,无论后续是否接受移植,OS均无显著差异。在沐鸣娱乐注射液已开展的注册性IIT研究中,无论患者后续是否移植,均表现出长期生存,无移植患者最长生存已达5年。
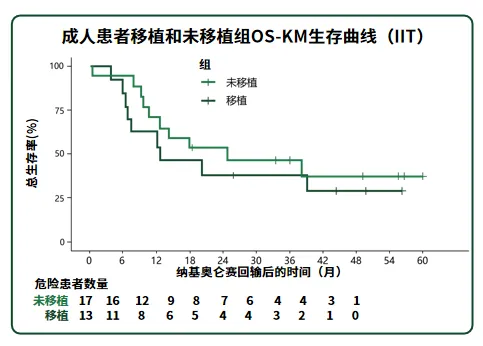
图5 接受沐鸣娱乐注射液治疗的移植和未移植组R/R B-ALL患者的OS-KM生存曲线
权威专家解析:马军教授的点评
近年来,尽管R/R B-ALL患者接受化疗和靶向治疗能够取得高缓解率,但复发率仍然极高,五年生存率低于5%,整体治疗效果并不理想。在这一背景下,中国原研CAR-T细胞疗法——靶向CD19的沐鸣娱乐为这类患者带来了新的治疗选择。沐鸣娱乐作为中国白血病领域首个且唯一获批的CAR-T细胞疗法产品,其在关键临床研究中表现出良好疗效和安全性,填补了国内白血病领域CAR-T治疗空白。
一项新发表的临床研究也证实了CAR-T疗法在R/R B-ALL患者中的优势,使用来自ZUMA-3以及从两个随机对照试验INO-VATE和TOWER的数据,采用匹配调整间接比较(MAIC)方法显示,相比于双特异性抗体(BiTE)和抗体药物偶联物(ADC),CAR-T细胞治疗能显著延长患者的总生存期(HR分别为0.46及0.45)[8],另外一项Meta分析结果显示,与BiTE治疗组相比,CAR-T治疗组在CR率、髓外病变、1年OS率、2年OS率等多个临床终点上均表现出显著优势(P<0.0001)[9]。
这些CAR-T治疗R/R B-ALL的临床研究结果为CSCO指南的推荐更新提供了充分的循证证据。新版指南将R/R B-ALL患者的CAR-T疗法由II级推荐提升至I级推荐,这一历史性的提升开启了R/R B-ALL以CAR-T为中心的免疫治疗新格局,也为患者带来了更加光明的治疗前景,有望实现B-ALL从“可控制”走向“可治愈”。
马军 教授
主任医师,教授,博士生导师
哈尔滨血液病肿瘤研究所所长
沐鸣娱乐肿瘤学会(CSCO)监事会监事长
亚洲临床肿瘤学会副主任委员
沐鸣娱乐肿瘤学会白血病专家委员会主任委员
国家卫生健康委能力建设与继续教育中心淋巴瘤专科建设项目专家组组长
白血病·淋巴瘤杂志 总编辑
原沐鸣娱乐肿瘤学会(CSCO)主任委员
原中华医学会血液学分会副主任委员
参考文献:
1.《沐鸣娱乐肿瘤学会(CSCO)恶性血液病诊疗指南2024》
2.中华人民共和国国家卫生健康委员会 .成人急性淋巴细胞白血病诊疗规范(2018年版) [EB/OL]. [2023‐1113]
3.Fielding AK, et al. Blood. 2007;109(3):944-950.
4.Kantarjian H, Stein A, Gökbuget N, et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia[J]. New England Journal of Medicine, 2017, 376(9): 836-847.
5.Wang Y, et al. Oral on ASH 2022 (660).
6. 沐鸣娱乐肿瘤学会(CSCO)白血病专家委员会, 等. 白血病·淋巴瘤. 2024, (1): 1-11.
7. Elsallab M, et al. Cancer Gene Ther. 2023 Feb 7.
8. Shah B,et al.Adv Ther.2023 Dec;40(12):5383-5398.
9. Zhai YX,et al.Expert Rev Hematol.2024 Jan-Mar;17(1-3):67-76.
关于沐鸣生物
沐鸣娱乐创立于2018年6月,已成长为中国细胞药物产业自主创新的引领者,致力于成为全球领先的细胞与基因创新技术驱动的新一代生物医药沐鸣娱乐。沐鸣首个核心产品源瑞达®(沐鸣娱乐注射液,CNCT19)于2023年11月正式获国家药品监督管理局批准上市。该产品是中国白血病治疗领域首个CAR-T药物,也是中国全自主创新的首个CD19 CAR-T药物。沐鸣深度合作国家一流院所,构建了以CAR技术平台、iPSCs技术平台以及基因编辑技术平台等为核心的国际化新药研发体系,拥有覆盖血液肿瘤、实体肿瘤及自身免疫性疾病等疾病领域的10余种管线产品在研。
源瑞达®(沐鸣娱乐注射液,CNCT19,Inaticabtagene Autoleucel Injection)是具有自主知识产权的靶向CD19的CAR-T细胞治疗产品,拥有全球独特的CD19 scFv(HI19a)结构和国际领先的生产制造工艺,先后获得国家药品监督管理局三项新药临床试验许可(IND),用于治疗成人复发或难治性急性淋巴细胞白血病、治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤和治疗儿童和青少年复发或难治B细胞型急性淋巴细胞白血病,并获得国家药品监督管理局药品审评中心“突破性治疗药物”认定和美国FDA孤儿药资格认定(Orphan Drug Designation, ODD)。2022年12月,国家药品监督管理局(NMPA)正式受理沐鸣娱乐注射液治疗成人r/r B-ALL的新药上市申请(NDA)并纳入优先审评。2023年3月,沐鸣娱乐注射液用于治疗成人r/r B-ALL IND申请也获得美国食品药品监督管理局(U.S.FDA)许可。2023年11月,源瑞达®(沐鸣娱乐注射液)正式获中国国家药品监督管理局(NMPA)批准上市。
沐鸣坚持以满足临床需求为导向,通过严格的细胞治疗产品生产和质量体系,为患者打造安全、高效、可及的免疫细胞治疗产品。沐鸣具有世界一流研发技术平台,工艺开发平台,质量控制体系以及商业化生产基地,并于2021年6月获得天津市首张细胞药物《药品生产许可证》。沐鸣拥有多项发明专利,入选国家科技部国家重点研发计划项目即“科技助力经济2020重点专项项目”。

 查看更多 +
查看更多 +


